Aldosteron
Aldosteron se luči u zoni glomerulozi, tankom, površnom sloju nadbubrežnih žlijezda. Aldosteron je najsnažniji mineralokortikoid koji reguliše intravaskularni volumen i elektrolitni balans, povećavajući reapsorpciju natrijuma i izlučivanje kalijuma u distalnim tubulima bubrega. Povećanom reapsorpcijom natrijuma repsorbuje se i voda, čime se povećava volumen krvi. Sinteza aldosterona počinje iz holesterola, kao i svih drugih steroida. U konverziji holesterola u aldosteron uključeni su enzimi: P450 scc, 3ß-HSDII, P450c2, i P450c11AS ili aldosteron sintetaza. Sinteza aldosterona je šifrovana genom CYP11B2.
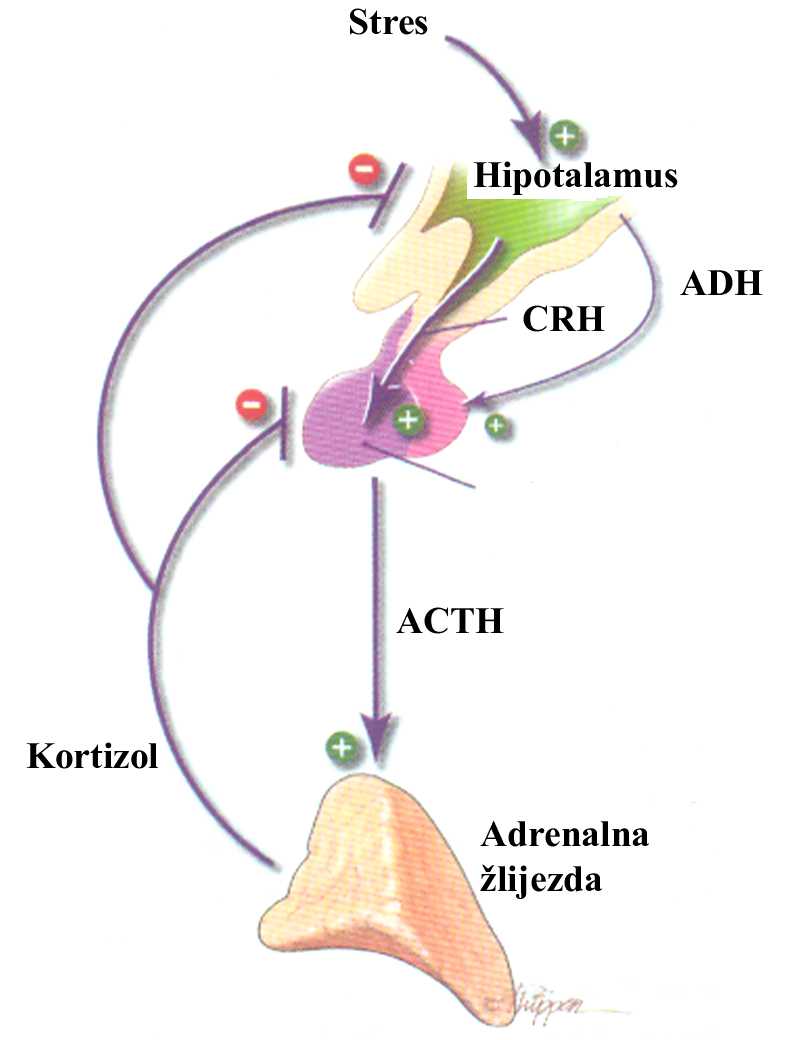
Prema sadašnjim saznanjima glavni činioci u regulaciji sekrecije aldosterona su sistem renin-angiotenzin, koncentracija kalijuma u ekstracelularnoj tečnosti, količina natrijuma u tijelu i adrenokortikotropni hormon. Produkcija i sekrecija aldosterona su predominantno regulisane sistemom renin-angiotenzin, koncentracijom kalijuma i kratkotrajnog dejstva ACTH. Renin je proteolitički enzim koji se proizvodi u blizini glomeluranog aparata bubrega. Njegovo izlučivanje u cirkulaciju stimulisano je naročito padom zapremine krvi u cirkulaciji i gubitkom Na. Nakon izlučivanja, renin djeluje na svoje supstrate i razlaže farmakološki inaktivni dekapeptid angiotenzin I. Angiotenzin converting enzim (ACE), koji se nalazi u plućima i plazmi, prevodi neaktivni angiotenzin I u farmakološki aktivni angiotenzin II, ocepljujući dipeptid od C-terminalnog kraja molekula. Angiotenzin II stimuliše izlulučivanje aldosterona. Angiotenzin II zatim razlaže aminopeptidaza do angiotenzina III, koji ima malu ili nikakvu presorsku aktivnost. I on stimuliše stvaranje aldosterona. Angiotenzinaze iz krvi i tkiva razlažu zatim angiotenzin III. Samo angiotenzin II ima značajnu presorsku aktivnost. Angiotenzin I, II i III sadrže 10, 8 i 7 aminokiselina. ACTH utiče na izlučivanje aldosterona, mada je ova kontrola samo eventualno važna pri stresnim situacijama i u slučaju kongenitalne adrenalne hiperplazije.
Najvažnija uloga aldosterona sastoji se u tome da kroz zid bubrežnih tubula pomaže reapsorpciju natrijuma iz tubula, a da istovremeno secernira kalijum koji se izlučuje urinom. Pod uticajem aldosterona može doći do pretjeranog gubitka kalijumovih jona urinom i do teške hipokalemije, u kojoj je dominantni simtom opšta slabost mišića. Aldosteron povećava sekreciju vodonikovih jona u tubulima zbog čega nastaje umjerena alkaloza.
Androgeni
Kora nadbubrežnih žlijezda neprekidno luči, posebno u fetusno doba, nekoliko osrednje aktivnih polnih hormona koji se nazivaju adrenalnim androgenima. Najvažniji od njih je dihidroepiandrosteron sulfat (DHEAS). Drugi adrenalni androgeni su dehidroepiandrosteron (DHEA), androstenedion i testosteron. Adultne osobe u toku dana izluče prosječno: DHEA 4 mg, DHEAS 7-15 mg, androstenediona 1,5 mg i testosterona 0,05 mg. DHEA je slab polni steroid, ali ima sposobnost konvertovanja u aktivne androgene i estrogene pod uticajem 3ß -HSD, što je od kliničkog značaja u mnogim stanjima i bolestima.
ACTH stimuliše sekrciju adrenalnih androgena; DHEA i androstenedion pokazuju cirkadialni ritam sličan kortizolu. Medjutim, postoji puno diskrepanci izmedju sekrecije adrenalnih androgena i glikokortikoida, što sugeriše da postoji dodatni stimulišući hormon za adrenalne androgene. Učinci androgena kore obično su mali. Medjutim njihovo djelovanje se povezuje sa ranim razvojem muških polnih organa u dječjoj dobi. Androgeni kore djeluju i u žena, i to ne samo prije puberteta, nego i tokom cijelog života. Oni uzrokuju veći rast aksilarnih i pubičnih dlaka. Za razliku od stabilnih vrijednosti koncentracije kortizola tokom života (bez većih odstupanja sa uzrastom) koncentracija DHEAS se mijenja sa uzrastom. Koncentracija se sa uzrastomm povećava. Porast koncentracije DHEAS u prepubertetskom uzrastu prethodi porastu gonadotropina. Poluživot DHEAS je 10-20 sati. Promjene adrenalne funkcije pred početak puberteta pripisuju se remodeliranju adrenalnog korteksa povećanjem dimenzija nadbubrežnih žlijezda. Nivo DHEAS je nizak u pacijenata sa Addisonovom bolesti, i kod pacijenata sa adrenalnom insuficijencijom.
Hormoni kore nadbubrežnih žlijezda se poslije sinteze prenose krvotokom do ciljnih ćelija, većinom vezani za proteine, a daleko manje u slobodnom obliku. Aktivnim mehanizmom ulaze u ćeliju, gdje se u citoplazmi vežu za specifične receptore. Tako hormon sa receptorom ulazi u ćelijsko jedro, veže se za vezno mjesto i djeluje na sintezu RNK. Razgradnja hormona nadbubrežnih žlijezda se najvećim dijelom odvija u jetri, mada postoji i njihov ekstrahepatični katabolizam. Glikokortikoidi se metabolišu u 17 hidroksisteroide (17-OHCS) i u tom obliku islučuju mokraćom. Mnogo manji dio glikokortikoida metaboliše se u 17-ketosteroide (17-KS) i u tom obliku izlučuje mokraćom. Androgeni hormoni se izlučuju mokraćom u obliku 17-KS. U ovom obliku se izlučuje i jedan dio androgena porijeklom iz testisa. Mineralokortikoidni hormoni se izlučuju mokraćom u obliku tetrahidroaldosterona i manjim dijelom neizmijenjeni kao aldosteron.
Prof. dr sci med. Božidar M. Bojović









Add comment