Prim. dr Nada Cicmil Sarić
Institut za onkologiju
Klinički centar Crne Gore
Prema statistici globalne svjetske statističke mreže za maligne bolesti koja objedinjava podatke za 185 zemalja, GLOBOCAN, godina 2020. je donijela 19,3 miliona novih slučajeva obolijevanja i 10 miliona smrtnih ishoda od malignih bolesti. Melanom čini svega 1% obolijevanja od svih tumora kože, ali je svakako najsmrtonosniji oblik kožnog tumora i uzrok je više od 75% smrtnih ishoda. Dužina preživljavanja zavisi od stadijuma bolesti: pacijenti sa metastatskim melanomom uglavnom imaju lošu prognozu, sa istorijskim stopama preživljavanja od 5 godina <10% do 2011. godine. Za čitavih 40 godina, od 1970. do 2010. u svijetu je urađeno 3337 kliničkih studija bez ikakvog konkluzivnog terapijskog benefita za ove pacijente.
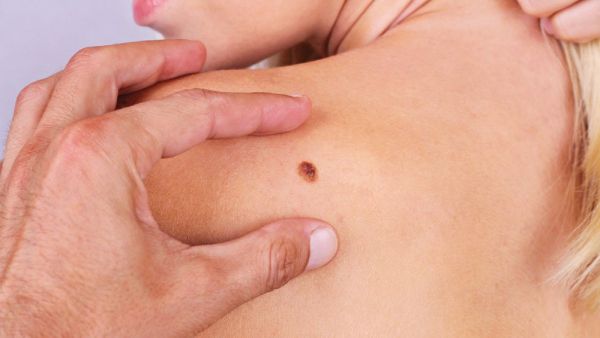
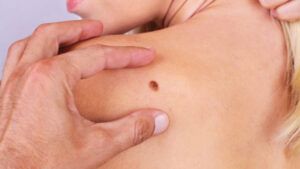 Iako je najčešće pigmentovan i najčešće se javlja na koži, melanom može biti i bez sadržaja tamnog pigmenta i lokalizovan u uvealnoj ovojnici oka, kao i na sluznicama: ždrijela, crijeva, dušnika, vagine, a veoma rijetko nastaje i na nekim drugim lokalizacijama. Melanom je veoma čest razlog umiranja od maligniteta u životnoj dobi do 35 godina. Muškarci obolijevaju češće nego žene, s tim što je polna distribucije nešto drugačija u dobi do 50 i poslije 50 godina života. Osobe blijede puti obolijevaju češće kao što i bijela rasa obolijeva mnogo više nego pripadnici crne rase. Nije rijetkost da se prije otkriju metastaze u limfnim čvorovima i/ili organima (pluća, mozak, jetra, kosti), a rjeđe i na veoma neobičnim lokalizacijama kao što je pankreas, želudac, nadbubrežna žlijezda…), nego što se ustanovi primarno ishodište bolesti. Ono može da ostane i trajno nepoznato, uprkos primjeni čak i najsavremenijih metoda dijagnostike kakva je PET CT. U svijetu je u 2020. godini od melanoma oboljelo 313 959, a umrlo 57 043 ljudi. GLOBOCAN i EUCAN procjenjuju stopu incidence melanoma u Crnoj Gori od 4.6 do 7,3. Ovaj podatak se uklapa u procjenu da zemlje Mediterana, gdje pripada i Crna Gora, imaju stopu obolijevanja od 5-7 na 100 000 stanovnika. Najveća stopa obolijevanja u Evropi je u Skandinaviji: 15 oboljelih na populaciju od 100 000. Pored svijetle puti, pretjerano izlaganje suncu, veliki broj sunčanih dana, primjena solarijuma (naročito prije 30 godina života), istanjenost ozonskog omotača, predstavljaju najznačajnije faktore rizika za obolijevanje od melanoma. Prema podacima Instituta za javno zdravlje Crne Gore objavljenim u julu 2018. u našoj zemlji je 2013. registrovano 59 novooboljelih od melanoma (više muškaraca nego žena), i 26 smrtnih ishoda od ove bolesti. Crna Gora još uvijek nema registar za melanom, ali se nadamo i vjerujemo da će aktuelna instalacija informacionog sistema u Kliničkom centru Crne Gore, kao i bliska i kontinuirana saradnja sa zemljama regiona, Hrvatskom, Srbijom i BiH koje su već nekoliko godina uključene u registar grupe zemalja CSEEMEG (Central and South-East European Melanoma Expert Group), uskoro i našu zemlju učiniti dijelom ove organizacije i njenog registra.
Iako je najčešće pigmentovan i najčešće se javlja na koži, melanom može biti i bez sadržaja tamnog pigmenta i lokalizovan u uvealnoj ovojnici oka, kao i na sluznicama: ždrijela, crijeva, dušnika, vagine, a veoma rijetko nastaje i na nekim drugim lokalizacijama. Melanom je veoma čest razlog umiranja od maligniteta u životnoj dobi do 35 godina. Muškarci obolijevaju češće nego žene, s tim što je polna distribucije nešto drugačija u dobi do 50 i poslije 50 godina života. Osobe blijede puti obolijevaju češće kao što i bijela rasa obolijeva mnogo više nego pripadnici crne rase. Nije rijetkost da se prije otkriju metastaze u limfnim čvorovima i/ili organima (pluća, mozak, jetra, kosti), a rjeđe i na veoma neobičnim lokalizacijama kao što je pankreas, želudac, nadbubrežna žlijezda…), nego što se ustanovi primarno ishodište bolesti. Ono može da ostane i trajno nepoznato, uprkos primjeni čak i najsavremenijih metoda dijagnostike kakva je PET CT. U svijetu je u 2020. godini od melanoma oboljelo 313 959, a umrlo 57 043 ljudi. GLOBOCAN i EUCAN procjenjuju stopu incidence melanoma u Crnoj Gori od 4.6 do 7,3. Ovaj podatak se uklapa u procjenu da zemlje Mediterana, gdje pripada i Crna Gora, imaju stopu obolijevanja od 5-7 na 100 000 stanovnika. Najveća stopa obolijevanja u Evropi je u Skandinaviji: 15 oboljelih na populaciju od 100 000. Pored svijetle puti, pretjerano izlaganje suncu, veliki broj sunčanih dana, primjena solarijuma (naročito prije 30 godina života), istanjenost ozonskog omotača, predstavljaju najznačajnije faktore rizika za obolijevanje od melanoma. Prema podacima Instituta za javno zdravlje Crne Gore objavljenim u julu 2018. u našoj zemlji je 2013. registrovano 59 novooboljelih od melanoma (više muškaraca nego žena), i 26 smrtnih ishoda od ove bolesti. Crna Gora još uvijek nema registar za melanom, ali se nadamo i vjerujemo da će aktuelna instalacija informacionog sistema u Kliničkom centru Crne Gore, kao i bliska i kontinuirana saradnja sa zemljama regiona, Hrvatskom, Srbijom i BiH koje su već nekoliko godina uključene u registar grupe zemalja CSEEMEG (Central and South-East European Melanoma Expert Group), uskoro i našu zemlju učiniti dijelom ove organizacije i njenog registra.
Dijagnostika melanoma se zasniva na kliničkom-dermatološkom pregledu, dermoskopiji, odstranjivanju promjene i histopatološkoj i verifikaciji kao i na pregledu limfnih čvorova regionalnih limfatičkih bazena, radiološkom pregledu pluća, ultrazvuku abdomena, a u slučaju postojanja kliničkih indikacija i snimanju mozga i koštanih struktura (ultrazvuk, skener, magnetna rezonanca, scintigrafija, pozitronska emisiona tomografija). Kod metastatskog melanoma se radi i imunohistohemijska i/ili molekularna PCR BRAF analiza. Rjeđe se radi analiza V600K, c-Kit i NRAS mutacija. Na laboratorijskom planu se pored standardnih hematoloških i biohemijskih parametara, prate i nespecifični, takozvani „surogat“ markeri: LDH i protein S 100. Klinički dermatološki pregled počiva na A, B, C, D, E kriterijumima, koji odgovaraju početnim slovima engleskih izraza (A: asymmetry, asimetrija; B: borde, granica; C: color, boja; D: diameter, dijametar E: evolving, evolucija).
Histopatološka analiza i analiza mutacionog statusa bolesti je kako temelj tako i finale za pravilnu dijagnozu, stadiranje i liječenje melanoma. Njen cilj je postaviti dijagnozu i utvrditi parametre važne za prognozu ali i predikciju ciljanog, kako potpornog liječenja, tako i liječenja bolesti u metastatskom stdijumu. Stadijum bolesti određujemo u skladu sa VIII verzijom AJCC (American Joint Committee of Cancer, 2018.) klasifikacije. Postoji više od petnaest parametara koje sadrži histopatološka analiza od kojih su najznačajnije: debljina tumora (Breslow), (ne) postojanje ulceracije, broj mitoza na vidnom polju, dubina tumorske invazije (Clark), eventualno postojanje mikrosatelitskih i/ili metastaza u prolazu, status resekcionih margina, status regionalnih limfonoda (SLNB; AD), prisustvo ili odsustvo limfocitne infiltracije i tip širenja bolesti.
Prevencija i screening su najuspješniji način sprečavanja da do bolesti uopšte dođe, da se ona prepozna u prelaznom stadijumu transformacije u malignu, invazivnu formu ili se otkrije u svom ranom stadijumu kada je u potpunosti izlječiva. U sklopu primarne prevencije, zaštita od jakog, direktnog sunčanog zračenja na plažama ali i na drugim mjestima, još od najranijeg djetinjstva kao i svijest o rizicima primjene solarijuma, naročito kod mladih ljudi, od najvećeg su značaja kada govorimo o melanomu kao jednom od samo pet, među više desetina, pa i stotina vrsta, danas poznatih malignih bolesti. U Crnoj Gori organizovani screening za melanom u okviru sekundarne prevencije, još uvijek nije uveden. Uvođenje screeninga, dermoskopije, rad na formiranju udruženja pacijenata koje bi se zajedno sa medicinskim stručnjacima bavilo podiznjem svijesti o melanomu zajedno sa formiranjem registra za melanom, a vremenom i centra za melanom, svakako su prioriteti naše onkološke ali i najšire društvene zajednice.
Adekvatan operativni zahvat u ranom stadijumu bolesti predstavlja i danas zlatni standard uspješnog liječenja melanoma. U značajnom procentu, primarna, adekvatna hirurgija sa odgovarajućim, slobodnim, bezbjedonosnim rubom prema okolnom, zdravom tkivu, predstavlja i jedini potrebni način liječenja bolesti. U ovom kontekstu je i biopsja stražarskog limfnog čvora (SLNB) sa obilježavanjem ili patent blue markerom ili radioizotopom. Kompletna disekcija pripadajuće lože limfne drenaže sve više se napušta, posebno od trenutka kada je uvedena primjena postoperativne adjuvantne terapije melanoma. Naravno da postoje situacije kada se disekcija radi: od onih kada postoji klinički detektibilna patološka limfadenopatija pa do nekih karakteristika SLNB odstranjenih limfnih čvorova koji se interpretiraju kao predznaci visokog rizika za rani relaps bolesti. U Crnoj Gori, obzirom da još uvijek nemamo mogućnost primjene adjuvantne terapije, disekcija regionalnih limfnih čvorova se još uvijek relativno često radi. Hirurški se tretiraju i “satelitske” lezije kao i “in transit” metastaze. Hirurgija je metoda od značaja i izbora kada je riječ i o bolesti koja je udaljeno metastazirala, ali samo na jedno mjesto. Danas je veoma čest oblik liječenja hirurška ekstirpacija metastatske promjene (najčešće iz mozga), a nakon toga primjena IMRT (intnzitet modulirane radioterapije, radiohirurgije), ciljano. Tako se, za slučaj potrebe, ostavlja prostora da se vremenom i neki drugi dio mozga tretira zračnom terapijom. Zračenje ima ulogu i u palijativnom tretmanu metastaza melanoma u koštanom sistemu tako što ostvaruje antidolorozni učinak kao i dodatno fiksiranje i stabilizacija koštanih regija, posebno onih koje pripadaju nosećim dijelovima skeleta. Osim kod oligo i polimetastatske bolesti, zračenje ima ulogu i u potpornom, adjuvantnom liječenju, odnosno zračenju regionalnog limfatičkog basena čiji limfonodi su bili zahvaćeni tumorom.
Medikamentozno liječenje melanoma je od 2010. godine do danas ostvarilo gotovo nevjerovatan napredak. Ipilimumab, anti CTLA-4 agens, je bio prvi lijek koji je od FDA odobren za liječenje metastatskog melanoma. Otkriće prisustva V600E mutacije kod BRAF pozitivnih tumora i prvog ciljanog lijeka, BRAF inhibitora vemurafeniba 2012. godine, kao i njegova uspješna primjena kod metastatske bolesti, je bila prva grudva u kasnijoj lavini otkrića za tretman metastatskog melanoma. Veća uspješnost radi preavazilaženja rezistencije, ali i manja toksičnost, postignuta je primjenom kombinacije BRAF i MEK inhibitora: COMBO dubleta: vemurafenib i cobimetinib, dabrafenib i trametinib. Razvijena je čitava paleta imunoloških ljekova anti PD-1 i anti PD-L1 agensa (pembrolizumab, nivolumab), koji djeluju na otklanjanje kočnica, dezinhibiciji postojanja programirane ćelijske smrti, što je specifičan mehanizam i nivo poremećaja imuniteta koji je prisutan kod oboljelih od ove vrste melanoma. Imunoterapija je djelotvorna i kod BRAF negativnih i kod BRAF pozitivnih oblika oboljenja. Imunološki ljekovi pojedinačno, a još više njihove kombinacije (anti PD-1, anti PD-L1, sami ili zajdeno sa anti CTLA-4 agensima), ispoljili su snažan i djelotvoran terapijski efekat kod oboljelih. Karakteristika ovog oblika liječenja je da se ono nešto sporije ispoljava, ali bolesnici koji dobro reaguju na ovu terapiju imaju dugotrajan terapijski odgovor i imunoterapiju dugo primaju. Pozitivan terapijski efekat imunoterapije se održava dugo nakon njenog obustavljanja u skladu sa preporukama važećih vodiča: ESMO; EADO; ASCO; NICE. Specifičnost imunološkog liječenja je u izvjesnom procentu slučajeva vezana i za tzv. pseudoprogresiju bolesti: od najvećeg značaja je imati u vidu ovu činjenicu kako bi se ne samo primjenom RECIST nego i imuno RECIST kriterijuma, stanje pravilno ocijenilo i kako se pacijentu ne bi uskratilo pravo i mogućnost na dalje liječenje i njegov dobar ishod. Kliničke registracione studije koje kao konačan rezultat dokazuju značajan terapijski učinak određenih ljekova u metastatskom stadijumu maligne bolesti, vremenom napreduju tako što ulaze u trajale koji ispituju djelotvornost ovih ljekova u potpornom, adjuvantnom setingu kod pacijenata čija bolest je nakon analize, sabiranja i procjene velikog broja faktora, svrstana u grupu visokog rizika za rani relaps. Odlaganje relapsa (kako lokalnog tako i pojave metastaza), sterilizacija eventualno prisutnih mikrometastaza, a kao proizvod toga i produžavanje preživjjavanja bolesnika, osnovni su zadaci koje treba da ispuni adjuvantna terapija. U posljednje tri godine, tri najveće studije su u polje adjuvantog liječenja melanoma (jedna od njih sa petogodišnjim rezultatima praćenja i sa krivuljom stope procjene dugovremenog održavanja postignutog pozitivnog rezultata), uvele primjenu jedne monoimunoterapije, jedne dvojne kombinacije imunoterapeutika i jedne od tri aktuelno postojeće target, COMBO terapije u adjuvantno liječenje melanoma visokog rizika kliničkog stadijuma III.
Bez obzira da li je riječ o liječenju metastatske bolesti ili adjuvantnoj primjeni terapije, izbor pravog lijeka, za pravog pacijenta, u pravo vrijeme je “uslov bez koga ne” za najveći terapijski benefit. Analiza stadijuma bolesti, histoloških i imunohistohemijskih karakteristika kao parametara rizika za relaps bolesti i predikcije odgovora na terapiju, životna dob, (ne)postojanje komorbiditeta, preference pacijenta i dostupnost ljekova, čine odluku o najboljem tretmanu za svakog pojedinca izuzetno kompleksnom. Liječenje ne samo da mora biti ciljano, nego mora biti i individualno skrojeno – “po mjeri” svakog bolesnika.
Pored djelotvornosti, rame uz rame sa njom po značaju stoji i bezbjedonosni profil ljekova koji se koriste kod melanoma. Princip “primum non nocere” i u ovom slučaju ostaje zlatni standard. Hemioterapija, čiji rezultati liječenja jedva da se može reći da su postojali i to u minimalnom procentu, praktično se više ne primjenjuje u tretmanu metastatskog melanoma. Sporadično, može de dati temozolamid. Kada je riječ o adjuvantnom liječenju, primjena niskodozažnog roferona je takođe napuštena dok je primjena visokodozažnog uvijek i bila predmet rasprave, najčešće zbog velike toksičnosti.
Savremeni ljekovi, ciljane, “target” terapije, pojedinačni kao i kombinacije BRAF i MEK inhibitora, kao najčešće neželjene efekte imaju različite oblike promjena na koži. Najveći procenat ovih lezija je malog obima, javlja se u početku terapije a kasnije slabi i iščezava. Rijetko je potrebno ordinirati antihistaminike ili kortikosteroide: za oralnu, parenteralnu ili lokalnu, kutanu primjenu. Sistemske alergijeske reakcije, krvarenja i smetnje u formi zamućenja vida su rijetke. Takođe je veoma rijetka i pojava nekog drugog oblika maligniteta kože. Fotoprotekcija suncu dostupnih dijelova kože je od najvećeg značaja u toku liječenja. Febrilnost je takođe dosta česta: može biti praćena dehidratacijom, superinfekcijom, elektrolitskim disbalansom i potrebom za hospitalnim liječenjem. U toku liječenja kod pacijenta osim opisanih simptoma i znakova kliničkog stanja, redovno pratimo i staus jetrenih enzima i elektrofiziološku funkciju srca, naročito eventualne promjene QT intervala. Primjena imunoterapije je kontraindikovana kod pacijenata sa autoimunim oboljenjima koji se liječe dugotrajno visokim dozama kortikosteroida i kod pacijenata kod kojih je urađena transplantacija i koji moraju biti na tretmanu imunosupresivima. Imunoterapeutici mogu dovesti do imunoloških oboljenja štitaste žlijezde, hipofize, pankreasa, jetre, bubrega, pluća, debelog crijeva, kože kao i neuroloških pormećaja koji inače spadaju u rijetke neurološke bolesti kakav je sindrom Guillain Barré. To je razlog da se u toku sprovođenja ovog oblika liječenja, kontinuirano moraju pratiti vrijednosti uree, kreatinina, šećera u krvi, transaminaza, elektrolita. Iako moguća, u praksi su ova neželjena djelovanja izuzetno rijetko izražena u najvećem, četvrtom stepenu, što se naročito odnosi na febrilni pneumonitis (čiji ishod može da bude i fatalan) i colitis (koji može biti tako težak da je neophodno intenzivno liječenje i praćenje od strane gastroenterohepatologa). Stevens-Johnsonov sindrom sa toksičnom epidermalnom nekrozom kože i sluznica se rijetko može javiti u toku imunoterapije, rjeđe u toku primjene COMBO dubleta, naročito ako ne postoji vremenska distance između imunotretmana/COMBO tretmana i zračne, obično palijativne terapije. Tada dehidratacija, elektrolitski disbalans, prostracija i poremećaji srčanog ritma mogu da budu uzroci letalnog ishoda.
Konačno, da se podsjetimo i uporedimo današnje podatke sa onim na početku izlaganja: do 2011. godine, petogodišnje preživljavanje u IV stadijumu melanoma je bilo manje od 10%, a zahvaljujući savremenom načinu liječenja ono danas iznosi 30%, odnosno, nakon pet godina, svaki peti pacijent je živ. Pored toga, značajan benefit ostvaruje i adjuvantna terapija: poboljšanje dužine života kod pacijenata sa visokim rizikom za relaps je veće za 30 do 50%. Neoadjuvantna terapija, primjena sistemskog liječenja (imunoterapije) prije sprovođenja operativnog zahvata, je budućnost koja je počela i otvorila najnoviju stranicu poboljšanja ishoda liječenja za oboljele od melanoma.
Svi stavovi i informacije dati u ovom tekstu su stavovi autora, a ne Glosarij CD
LITERATURA:
- IARC, WHO, Latest global cancer data. Lyon, France, 15 December
- Anthony J. Alberg, Noelle K. LoConte, Lewis Foxhall, Martin A. Weinstock, Scarlett Lin Gomez, Michael Francisco, E. Allyn Moushey, and Jeffrey E. Gershenwald, American Society of Clinical Oncology Policy Statement on Skin Cancer Prevention. ASCO special articles. JCO Oncology Practice. May 2020.
- Lauren E. Davis, Sara C. Shalin & Alan J. Tackett Current state of melanoma diagnosis and treatment, Reiew Article Cancer Biology & Therapy, Volume 20, 2019. – Issue 11Published online: 01 Aug 2019.
- Siddhartha Sood, Rahul Jayachandiran and Siyaram Pandey. Current advancements and novel strategies in the treatment of metastatic melanoma. Integr Cancer Ther Jan-Dec 2021;20:1534735421990078.doi: 10.1177/1534735421990078
- Ahmad A Tarhini. The current state of adjuvant therapy of melanoma The Lancet Oncology Volume 21, ISSUE 11, P1394-1395, November 01, 2020.
SKRAĆENICE:
AJCC: American Joint Committee on Cancer
AD: axxillary dissection
ASCO: American Society of Clinical Oncology. ASCO
AD: axillary dissection
BRAF: v-raf murine sarcoma viral oncogene homolog B1
c-Kit: the gene encoding the receptor tyrosine kinase protein known as tyrosine-protein kinase KIT, CD117 (cluster of differentiation 117)
COMBO: kombinovana terapija BRAF i MEK inhibitorima
CSEEMEG: Central and South-East European Melanoma Expert Group
CTLA-4: cytotoxic T-lymphocyte-associated protein 4
EADO: European Association of Dermatological Oncology
ESMO: European Society for Medical Oncology
EUCAN: European Cancer Observatory
GLOBOCAN: Global Cancer Incidence, Mortality and Prevalence
IARC: International Agency for Research on Cancer)
iRECIST: iRECIST for the objective monitoring of immunotherapies was published by the official RECIST working group in 2017.
MEK: drug that inhibits the mitogen-activated protein kinase kinase enzymes MEK1and/or MEK2
NICE: The National Institute for Health and Care Excellence
NRAS: an enzyme that in humans is encoded by the NRAS gene
PD-1 iPD-L1: are a group of checkpoint inhibitor anticancer drugs that block the activity of PD-1 and PDL1 immune checkpoint proteins present on the surface of cells. Immune checkpoint inhibitors are emerging as a front-line treatment for several types of cancer
nd/or MEK2.
PET CT: positron emission tomography and computed tomography
RECIST: Response evaluation criteria in solid tumors
SLNB: Sentinel lymph node biopsy
V600E i V660K: V600E is a mutation of the BRAF gene in which valine (V) is substituted by glutamic acid (E) at amino acid 600; V600K is another prevalent BRAF mutation at the same residue is V600K mutation in which the valine residue is replaced by a lysine through two nucleotide substitution
WHO: World Health Organisation







Add comment