Mr ph Najdana Gligorović Barhanović, direktorica laboratorije Moj Lab
Subspec. laboratorijske endokrinologije
Najčešća metabolička bolest koštanog tkiva je osteoporoza. U razvijenim zemljama predstavlja značajan socijalni i medicinski problem, jer bilježi eksponencijalan porast broja oboljelih usljed generalnog starenja stanovništva. Definiše se kao progresivna, sistemska metabolička bolest kostiju čije su odlike gubitak koštane mase, oštećenje mikroarhitekture koštanog tkiva i povećanje fragilnosti, što za posljedicu ima porast rizika od nastajanja fraktura. U novije vrijeme bolest “ne bira godine”. Preventivno određivanje laboratorijskih markera, o kojima će biti govora u daljem tekstu, od značaja je u cilju pravovremenog otkrivanja bolesti i uvođenja odgovarajuće terapije.
Osteoporoza je tiha bolest bez simptoma, ali njene kliničke posljedice mogu biti iscrpljujuće. Najčešći prelomi, koji su posljedica osteoporoze, uključuju kičmene pršljenove, distalni radijus i proksimalni femur. Sve frakture su povezane sa morbiditetom, a frakture kuka sa mortalitetom. Svaka peta žena starija od 50 godina, koja je imala prelom kuka, umire u prvoj godini poslije zadobijenog preloma.
Dijagnostički kriterijum Svjetske zdravstvene organizacije (WHO) za osteoporozu uključuje mjerenje mineralne gustine kostiju (bone mineral density – BMD) sa standardnom devijacijom (SD) ≥2.5 ispod srednje vrijednosti za mlade zdrave žene (T-skor ≤ -2.5 SD). Osteopenija označena graničnim smanjenjem BMD-a, definisana je BMD T-skorom između -1.0 i -2.5 koji je baziran na najšire primjenjivanoj tehnici mjerenja BMD-a, dvoenergetskom rendgenskom apsorpciometrijom (DXA). Iako se BMD koristi u dijagnostici osteoporoze, niska vrijednosti ne samo što nije jedini faktor, već je ukoliko se koristi sama za sebe neefikasan alat u identificiranji osoba s visokim rizikom za frakture. Zato se prilikom izbora pacijenata za liječenje, rizik za svakog pojedinačno izračunava primjenom algoritma koji uključuje niz priznatih faktora koji doprinose razvoju povećane fragilnosti koštanog tkiva. Uz BMD tu su: dob, pol, indeks tjelesne mase, porodična istorija, lična istorija preloma, sekundarni uzroci osteoporoze, kao što su reumatoidni artritis, korištenje ljekova kao što su glukokortikoidi, pušenje i visok unos alkohola.
Značajno mjesto u dijagnostici, utvrđivanju etiologije i praćenju efekata izabrane terapije osteoporoze imaju laboratorijski markeri homeostaze koštanog tkiva. To su u prvoj liniji najstariji, tzv. markeri neorganskog matriksa (kalcijum ukupni i jonizovani, fosfati, magnezijum), zatim hormoni usko vezani za metabolizam ovih elemenata (PTH i vitamin D) i u novije vrijeme, markeri koštanog remodeliranja (turnovera). Pored nabrojanih postoji cijeli niz drugih hormona, proinflamatornih jedinjenja i faktora rasta uključenih u metabolozam kostiju. Sa izuzetkom neorganskih markera, ovi parametri određuju se imunohemijskim tehnikama koje nisu standardizovane, usljed čega ih prati velika neusaglašenost o kojoj se mora voditi računa prilikom interpretacije rezultata.
Paratireoidni hormon PTH luče parne paratireoidne žlijezde (kojih najčešće ima četiri) smještene iza štitne žlijezde. To je peptidni hormon sastavljen od 84 amino kisjeline i ima centralnu ulogu u homeostazi kalcijuma, fosfora i zdravlju kosti.
Sekrecija PTH nalazi se pod kontrolom koncentracije jonizovanog kalcijuma, a glavna dejstva hormona su usmjerena ka povećanju nivoa ovog minerala u krvi kroz: ubrzavanje reapsotpcije kalcijuma u distalnim, uz istovremeno smanjenje reapsorpcije fosfata u proksimalnim tubulima, aktivacia 1α-hidroksilaze 25-hidroksi vitamina D3 i stimulacija osteoklastične resorpcije kostiju. Vrijednosti PTH u krvi su najčešće povećane usljed sekundarnog hiperparatireoidizma koji može biti posljedica deficita vitamina D ili hronične bubrežne bolesti. Vrijednosti mogu biti povećane i kod primarnog hiperparatireoidizma (adenom, hiperplazija ili karcinom žlijezde), te tercijerng hiperparatireoidizam (nakon transplanatcije bubrega) i pseudohipoparatireoidizma.
Generalno gledano, određivanje peptidnih hormona (TSH, LH, FSH…) nije u analitičkom smislu zahtjevno, međutim kada je u pitanju PTH dodatno je komplikovano usljed heterogenosti cirkulišućih formi hormona. Na periferiji PTH se brzo razgrađuje (t1/2 2-4min) do biološki inaktivnih ali imunoreaktivnih fragmenata koji interferiraju prilikom određivanja hormona standardnim imunohemijskim metodama. Cirkulišući imunoreaktivni PTH pored cijele, intaktne molekule (iPTH), sastoji se od kompleksne smješe N-terminalnih fragmenta i različitih tipova C-terminalnih fragmenata, što uzrokuje međusobnu varijabilnost testova različitih proizvođača usljed različite specifičnosti korišćenih antitijela (Slika 1). PTH test III generacije, za razliku od prethodnih, mjeri cijeli molekul PTH – jedini biološki aktivni oblik. Ostalim testovima mjere se i različiti djelovi ovog hormona koji nemaju aktivnost, te se dobijaju lažno povećane vrijednosti. Takvi rezultati vode cijelom nizu nepotrebnih dodatnih testiranja i pregleda, izlažu pacijente neopravdanom stresu.
Uzorak za određivanje PTH treba uvijek uzimati u isto vrijeme uz maksimalnu kontrolu preanalitičkih faktora. Lučenje hormona karakteriše bifazni dnevni ritam sa pikovima između 2 – 6 i 16-19 časova. Mada su kod pojedinih osoba primijećene i šire varijacije (čak dvostruke) prosječna promjena vrijednosti PTH u toku dana iznosi oko 10% i zahtijeva standardizaciju vremena uzorkovanja (8:30-9:30 ujutro). Intraindividualni koeficijent varijacije kod osoba kojima su uzorci uzeti u isto vrijeme još je i veći (oko19% kod zdravih osoba) što znači da vrijednosti moraju promijeniti za 54% kako bi bili u potpunosti sigurni da je u pitanju prava tj. klinički relevantna promjena.
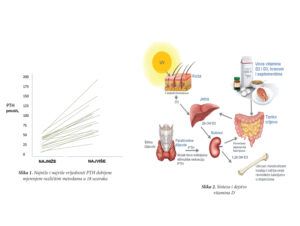 Uprkos ovim saznanjima PTH i dalje ima važno mjesto u diferencijalnoj dijagnsotici hiper i hipokalcemija, kao i u menadžmentu sekundarnog hiperparatireoidizma. Ipak, kliničke odluke u vezi pacijenta ne treba donostiti na bazi jedne dobijene, već na trendu promjene vrijednosti iPTH. Prilikom tumačenja dobijenog rezultata mora se uzeti u obzir i uticaj vrijednosti drugih parametara kao što su fosfati i alkalna fosfataza. Svi tipovi poremećaja metabolizma kostiju mogu se naći u širokom opsegu PTH vrijednosti, te je neophodan i monitoring ostalih laboratorijskih markera.
Uprkos ovim saznanjima PTH i dalje ima važno mjesto u diferencijalnoj dijagnsotici hiper i hipokalcemija, kao i u menadžmentu sekundarnog hiperparatireoidizma. Ipak, kliničke odluke u vezi pacijenta ne treba donostiti na bazi jedne dobijene, već na trendu promjene vrijednosti iPTH. Prilikom tumačenja dobijenog rezultata mora se uzeti u obzir i uticaj vrijednosti drugih parametara kao što su fosfati i alkalna fosfataza. Svi tipovi poremećaja metabolizma kostiju mogu se naći u širokom opsegu PTH vrijednosti, te je neophodan i monitoring ostalih laboratorijskih markera.
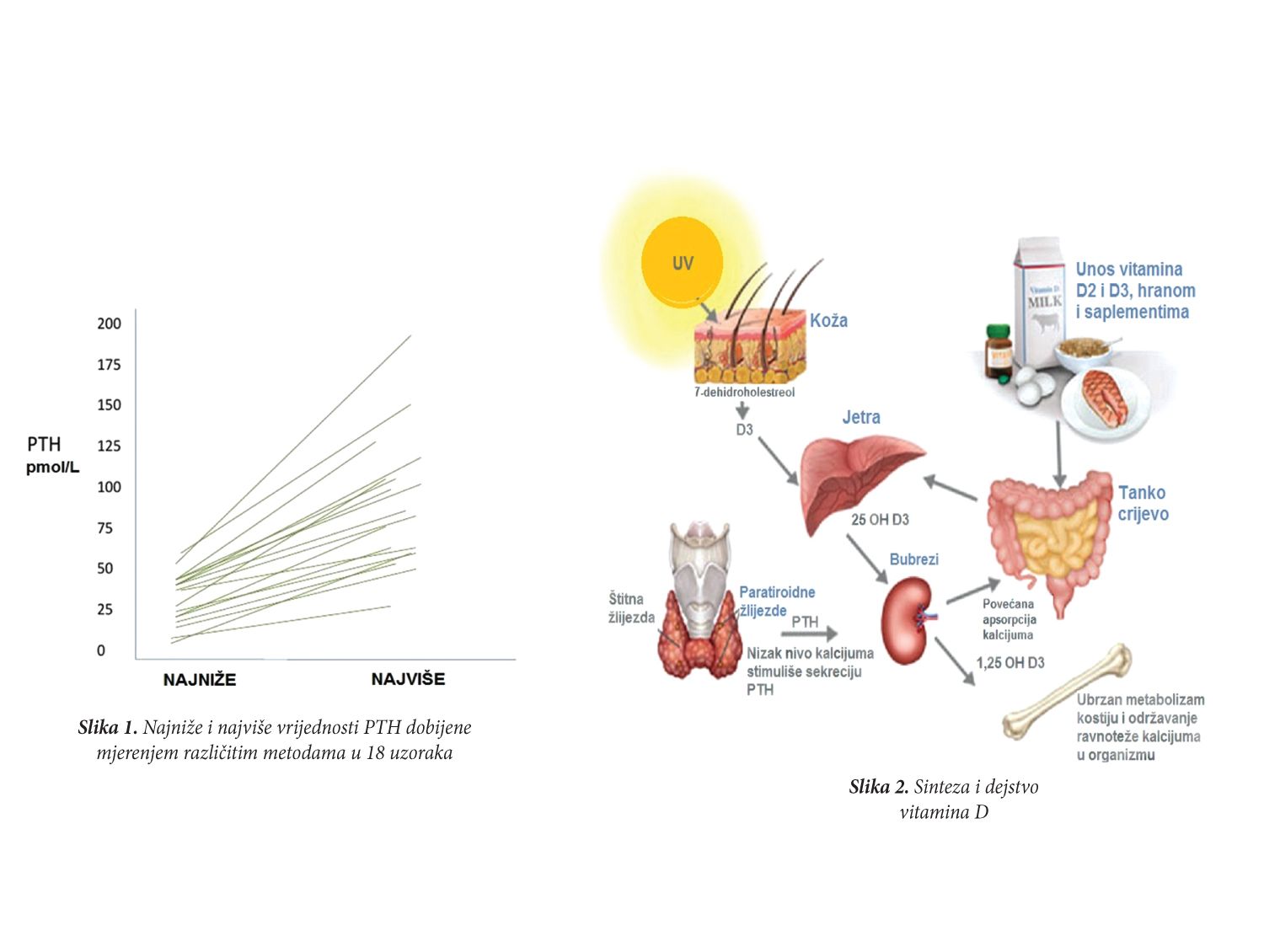
Vitamin D nije pravi vitamin, to je prije prohormon koji nastaje fotohemijskom reakcijom u koži iz 7-dehidroholesterola. Vitamin D i njegovi metaboliti su holekalciferoli ili ergokalciferoli. Holekalciferol (vitamin D3) je polazno jedinjenje za familiju koja se nalazi u prirodi i produkuje se u koži iz 7-dehidroholesterola pri izlaganju ultraljubičastoj sunčevoj svjetlosti. Vitamin D2 (ergokalciferol) nastaje iz ergosterola i ima samo jednu trećinu aktivnosti vitamina D3. Metabolizam vitamina D prikazan je na slici 2.
Kada je u pitanju laboratorijska procjena deficita vitamina D pitanje koje se prvo postavlja je šta mjeriti: 25(OH) ili 1,25(OH) vitamin D (kao njegovu aktivnu formu)? Istraživanja su pokazala da 25OH vitamin D daje klinički korisniju procjenu statusa u organizmu jer ima relativno dugačko poluvrijeme života (3 nedjelje) usljed čega je pouzdan indikator rezervi u organizmu nastalih bilo izlaganju UV zracima bilo saplementacijom, a sinteza primarno zavisi od količine dostupnog supstrata. Sa druge strane poluvrijeme života 1,25OH vitamina D je svega 4h i produkcija je usko regulisana potrebama organizma za kalcijumom.
Određivanje dodatno komplikuje i prisustvo 2 forme vitamina D (D2 i D3). Imunohemijski testovi mjere uglavnom ukupni vitamin D, a moguće ih je razdvojiti drugim fizičko hemijskim tehnikama (LC-MS). Različite studije pokazale su da testovi pojedinih proizvođača uopšte ne mjere D2.
Intermetod varijabilnosti, pored različite specifičnost antitijela koja se koriste u odnosu na D2 i D3 i činjenice da neki testovi mjere samo 25(OH), drugi 1,25(OH), a treći ukupni vitamin D (uglavnom zastupljeni u Crnoj Gori), doprinose i nedostatak internacionalno priznatog referentnog standarda, te različitosti jedinjenja koje proizvođači koriste za oslobađanje iz kompleksa sa proteinima.
Tabela 1. Threashold vrijednosti za 25(OH) vitamin D
| Jedinice
nmol/L ng/ml |
Status | |
| < 30 | < 12 | Deficit |
| 30 – 50 | 12 – 20 | Nedovoljan nivo |
| ≥ 50 | ≥ 20 | Zadovoljavajući nivo |
| > 150 | > 60 | Potencijalna toksičnost |
Deficit vitamina D može biti posljedica: smanjenog unošenja tokom dužeg vremenskog perioda, limitiranog izlaganja sunčevoj svjetlosti, bolsti bubrega i malapsorpcije. Uobučajene manifestacije deficita su rahitis kod djece i osteomelacija kod odraslih. Osteoporoza je, sa druge strane, pravi primjer efekta dugoročnog deficita kalcijuma, ali i vitamina D čije niske vrijednosti uslovlajvaju sniženu apsorpciju ovog minerala.
Glavna indikacija za određivanje je pojava simptoma deficita (proksimalna mišićna slabost, perzistirajući mišićno-skeletni bol…), zatim hipokalcemija, porast vrijednosti PTH nepoznatog uzroka i u cilju monitoringa pacijenata na terapiji visokim dozama.
Pored osteoporoze, istraživanja sprovedena u zadnjih 15 godina ukazuju i na pozitivan efekat adekvatne saplementacije vitaminom D u prevenciji kolorektalnog i karcinoma prostate, diabetes tip I i II, intolerancije na glukozu, hipertenzije, multiple skleroze, različitih autoimunih bolesti i brojnih drugih poremećaja.
U posljednje dvije decenije ispituje se cijeli niz markera koštanog turnover u cilju procjene osteoporoze i drugih bolesti metabolizma kostiju. Koštano tkivo je visokodiferentovano tkivo uz dinamičnost koja se ogleda u stalnom procesu remodeiranja zasnovanom na koštanoj resorpciji i formiranju. U osteoporozi povišeno je remodeliranje kosti uz dominaciju koštane resorpcije tj. postoji nejednakost u količini novoformirane i resorbovane kosti. Biohemijski markeri remodeliranja koštanog tkiva obuhvataju markere formiranja i markere resorpcije kostiju (Tabela 2).
Tabela 2. Biohemijski markeri remodeliranja koštanog tkiva
| Marker | Skraćenica | Biološki materijal |
| Markeri formiranja kostiju | ||
| Osteokalcin | OC | |
| Nedovoljnokarboksilisani | OC | Serum |
| Ukupni | ukupni OC | Serum |
| Intaktni | OC (1-49) | Serum |
| N-mid fragment ostekalcina* | OC (1-43) | Serum |
| Koštana alkalna fosfataza** | košALP | Serum |
| Tip I kolagen propeptidi | Serum | |
| Prokolagen tip I N propeptid ** | PINP | Serum |
| Monomer prokolagen tip I N propeptida | mon PINP | Serum |
| Inatktni prokolagen tip I N propeptida | intakt PINP | Serum |
| Ukupni prokolagen tip I N propeptid | ukupni PINP | Serum |
| Prokolagen tip I C propeptid | PICP | Serum |
| Markeri resorpcije kostiju | ||
| Piridinolin | PID | Urin |
| Deoksipiridinolin | DPD | Urin/Serum |
| Tip I kolagen tjelopeptidi | ||
| N-terminalni crosslinked telopeptid tip I kolagen ** | NTX-I | Urin/Serum |
| C-terminalni crosslinked telopeptid tip I kolagen* ** | CTX-I | Urin/Serum |
| C-terminalni crosslinked telopeptid tip I kolagen generisan od strane matriks metaloproteaza | CTX-MMP | Serum |
| Tartarat rezistentna kisjela fosfataza | TrACP | Serum |
*Markeri dostupni u laboratorijama u Crnoj Gori;
**Markeri koji se najčešće određuju
Još uvijek nisu uvršteni u zvanične vodiče za osteoporozu jer nedostaju podaci iz prospektivnih populacionih studija. Od značaja su u identifikaciji pacijenata sa visokim rizikom za frakture. Pouzdano je utvrđena relevantnost određivanja u monitoringu terapije, preporučuje se mjerenje jednog markera prije i 3-6 mjeseci nakon otpočinjanja sa liječenjem, jer promjene u vrijednostima bolje objašnjavaju smanjenje rizika od fraktura u odnosu na BMD promjene koje su uočljive tek nakon 12-24 mjeseca. Očekuju nas dalja istraživanja o njihovom značaju u predikciji brzine gubitka koštane mase, identifikaciji sekundarne osteoporoze i poboljšanju komplijanse.
S obzirom na porast broja oboljelih od osteoporoze i primjene novih antiresorptivnih ljekova, Međunarodna fondacija za osteoporozu (objavila je prporuke o vrsti markera koju treba koristiti – marker formiranja: kod nas dostupan osteokalcin u serumu ; marker razgradnje kostiju: kod nas dostupan beta cross laps u serumu, broju markera koje treba mjeriti – jedan formiranja i jedan razgradnje, pri čemu prednost imaju oni koji se mjere u serumu) i svođenju uticaja preanalitičkih faktora na minimum. Kako vrijeme sakupljanja uzorka, kao i razmak u odnosu na zadnji obrok bitno utiču na dobijene vrijednosti, neophodno je standardizovati protokol uzorkovanja tj. krv treba uzeti na tašte prije 9 sati, a ukoliko se kao uzorak koristi urin preporučuje se prvi ili drugi jutarnji uzorak. Pored cirkardijalnog ritma pri interpretaciji rezultata moraju se uzeti u obzir i drugi faktori kao što su: starost, pol, menopauza, funkcija jetre i brzina glomerularne filtracije.
Laboratorijski markeri metabolizma kostiju: ukupni i jonizovani kalcijum, neorganskog fosfor, PTH, vitamin D, osteokalcin i beta cross laps.










Add comment